This is a translation in Polish. You can also read the original English version.
Polish-3rd-blog
April 07, 2021
Wyniki Konsorcjum COVID-19 HGI z analizy nr 5
(Styczeń 2021)
02 marca 2021
Napisane przez Minttu Marttila, Annika Faucon, Nirmal Vadgama, Shea Andrews, Brooke Wolford, and Kumar Veerapen w imieniu Konsorcjum “COVID-19 HGI”
Przetłumaczone na język polski przez Karolinę Chwiałkowską, Elżbietę Kaja, Dorotę Pasko.
Informacja: Konsorcjum COVID-19 Host Genetics Initiative (HGI) reprezentuje ponad 2000 naukowców z ponad 54 krajów współpracujących, aby dzielić się danymi, pomysłami, rekrutować pacjentów i rozpowszechniać wspólnie uzyskane wyniki. Aby zapoznać się z projektem naszych badań, przeczytaj inauguracyjny post na blogu. Nasze badania są ciągle w toku, a wyniki prezentujemy iteracyjnie i podsumowujemy przez posty na blogu i w sekcji z wynikami na naszej stronie internetowej. Jeżeli jakiekolwiek słownictwo tego tekstu jest niezrozumiałe, prosimy kierować zapytania drogą mailową na adres hgi-faq@icda.bio – chętnie zaktualizujemy informacje w celu ich wyjaśnienia. W najbliższych tygodniach zostaną udostępnione dodatkowe materiały wyjaśniające koncepcję i terminologię projektu. W międzyczasie, w celu poznania podstaw genetyki proponujemy zajrzeć tutaj.
Artykuł naukowy opisujący najnowsze wyniki jest dostępny tutaj.
Najnowsza analiza (nr 5) została wykonana na większej niż poprzednio grupie badanych oraz zyskała większą wiarygodność odkryć genetycznych.
Konsorcjum COVID-19 HGI regularnie publikuje obszerne dane genetyczne pochodzące ze swoich badań prowadząc największe w historii analizy typu GWAS (Genome Wide Association Study). Analiza jest rekordowa zarówno pod względem ilości uczestników projektu (ponad 2 miliony osób), jak również liczby zaangażowanych badaczy (ponad 2000 naukowców). Poniżej opisujemy wyniki najnowszej, piątej analizy. W poprzedniej analizie (nr 4) opublikowaliśmy warianty genetyczne w genomie człowieka powiązane z ciężkim przebiegiem choroby COVID-19 (przeczytaj nasze post na blogu dedykowane dla osób niezwiązanych z nauką z analizy 3 i analizy 4). Zidentyfikowaliśmy te warianty poprzez analizę GWAS przeprowadzoną dla 30 000 osób zakażonych SARS-CoV-2 (grupa badana) i 1,47 miliona osób nie zakażonych (grupa kontrolna). W analizie nr 5 zwiększyliśmy liczebność grup do prawie 50 000 w grupie badanej oraz do ponad 2 milionów osób w grupie kontrolnej, poprzez połączenie danych z 47 projektów prowadzonych w 19 krajach (Rysunek 1). Dzięki zwiększeniu liczebności obu grup, poprawiła się przede wszystkim wiarygodność naszych wyników. W poniższej analizie, podjęliśmy również próbę zwiększenia różnorodności populacji. Analizowanie genów w populacjach o zróżnicowanym pochodzeniu etnicznym pomaga lepiej zrozumieć genetyczne warianty wpływające na ciężkość przebiegu choroby COVID-19 oraz ich obecność w populacjach na całym świecie. Spośród 47 zaangażowanych w analizę projektów naukowych, 19 zawiera próbki pochodzące spoza Europy.
Rysunek 1. Lista partnerów Konsorcjum HGI COVID-19, którzy przyczynili się do analizy nr 5. Spośród 47 projektów, 19 zawiera dane populacji spoza Europy. Na podstawie prezentacji Andrei Ganna na temat HGI COVID-19 z dnia 25 stycznia 2021.
Struktura badania
Podobnie jak podczas poprzednich badań, przeprowadziliśmy trzy typy analiz (Rysunek 2): A) krytyczny przebieg COVID-19 (kończący się wspomaganiem oddychania lub śmiercią z powodu COVID-19), B) hospitalizacja z powodu COVID-19 i C ) podatność na zakażenie SARS-CoV-2. Analizy te mają na celu uchwycenie cech genetycznych związanych zarówno z podatnością na zakażenie SARS-CoV-2, jak i ciężkością przebiegu COVID-19. Ostatnia analiza (Analiza C) miała na celu wykrycie wariantów genetycznych przyczyniających się do zakażenia SARS-CoV-2. Analiza ta obejmowała wszystkie przypadki choroby COVID-19, niezależnie od obecności lub nasilenia objawów. Wyniki analizy, definicje przypadków i kontroli oraz liczebność prób przedstawiono na Rysunku 2.
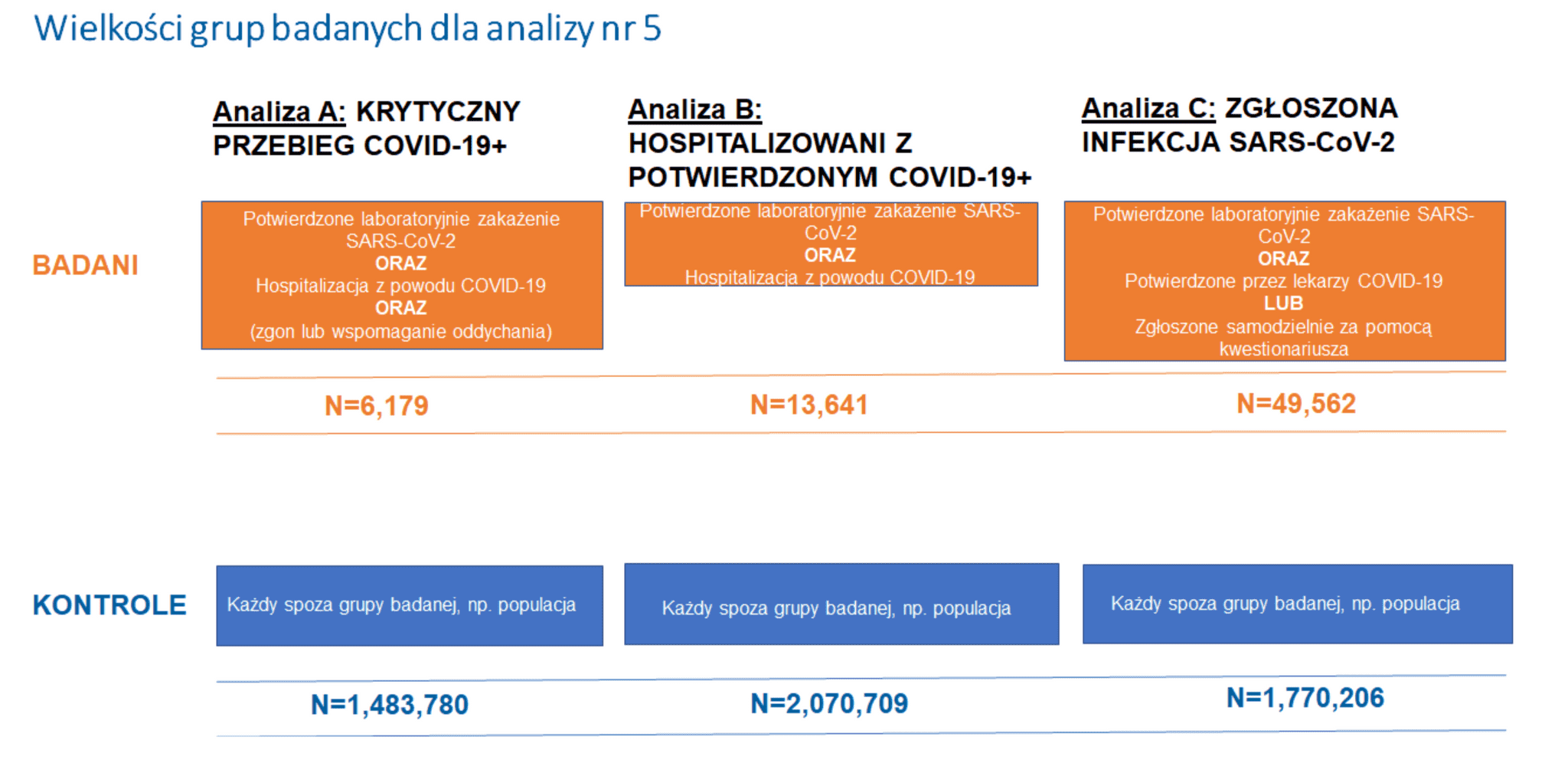
Rysunek 2: Definicja przypadków (badanych) i kontroli dla każdej analizy w badaniu nr 5. Należy zauważyć, że SARS-CoV-2 to wirus, który powoduje chorobę COVID-19. Na podstawie prezentacji Andrei Ganna z 25 stycznia 2021 r.
Regiony genomu związane z COVID-19 wskazują na zaburzenia odporności wrodzonej i dysfunkcję płuc
Po zebraniu danych genetycznych dostarczonych przez naszych współpracowników, przeprowadziliśmy GWAS zgodnie z definicjami na Rysunku 2. Wcześniej, w analizie nr 4, podkreślaliśmy nowe sygnały genetyczne dotyczące podatności i ciężkości COVID-19 w 7 regionach chromosomów. Regiony te wskazują na etiologię w zaburzeniach odporności wrodzonej i dysfunkcji płuc zgodnie z wiodącą wiedzą kliniczną dotyczącą zakażeń COVID-19. W analizie nr 5 zidentyfikowaliśmy 15 regionów istotnych w skali całego genomu we wszystkich chromosomach: region chromosomu 1 wykazywał istotność w skali całego genomu tylko w analizie krytycznie chorych (analiza A); region chromosomu 11 ma większy wpływ w analizie ciężkości przebiegu choroby niż w podatności na zakażenie (analiza B); a 4 z tych regionów chromosomowych są specyficzne dla zakażenia zgłoszonego przez SARS-CoV-2 (analiza C). Na Rysunku 3 przedstawiamy graficzną reprezentację tych wyników jako wykres w Miami (panelowa wersja wykresu Manhattan. Nazwana na cześć Miami, jako odzwierciedlenie odbicia panoramy Miami na wodzie).
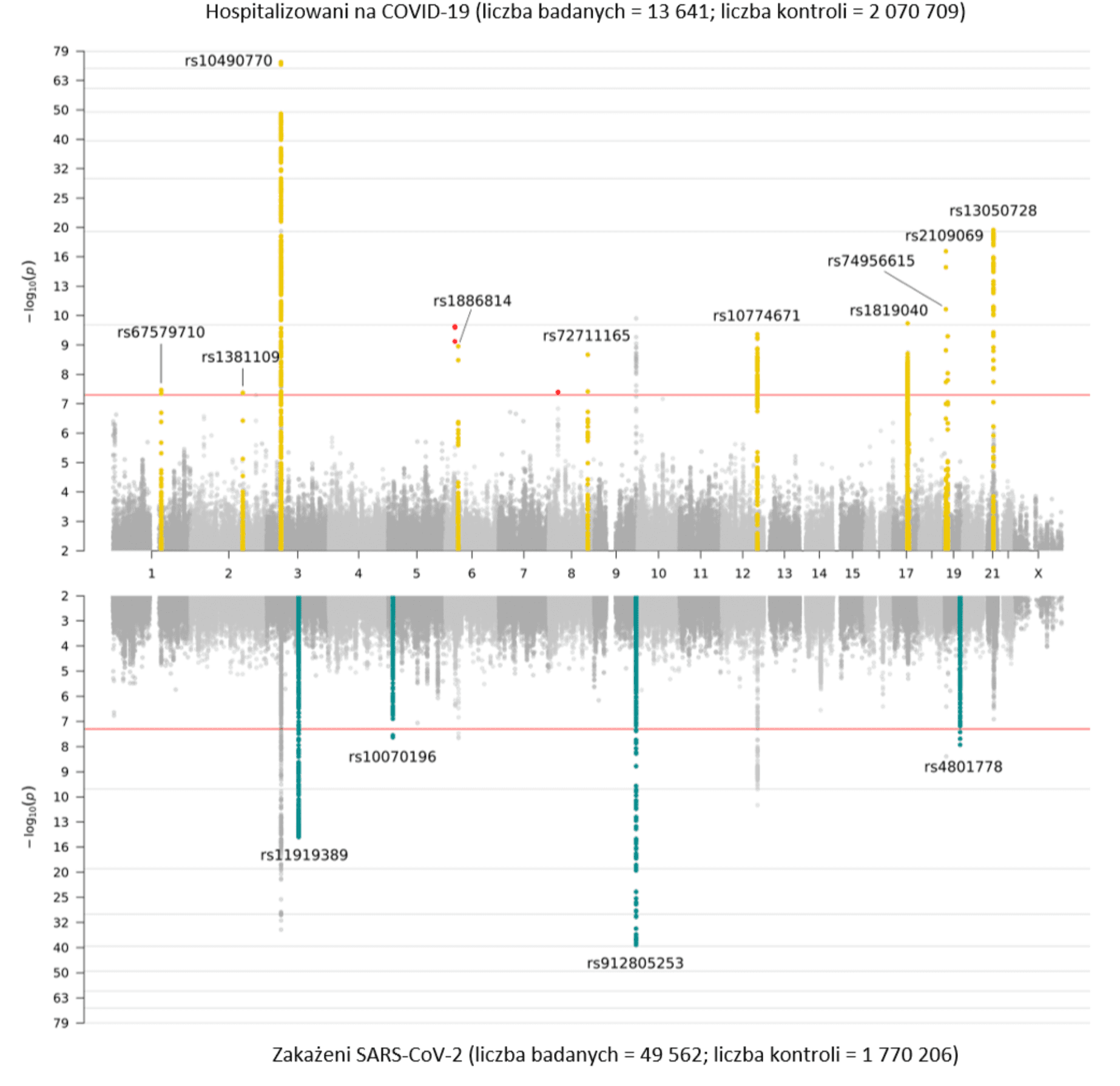
Rysunek 3. Wykres Miami przedstawiający wyniki asocjacji całego genomu dla COVID-19. Górny panel przedstawia wyniki badania asocjacyjnego całego genomu pacjentów hospitalizowanych z powodu COVID-19 i kontroli (analiza B), a dolny panel wyniki związane z podatnością na zakażenie SARS-CoV-2 w stosunku do kontroli (analiza C).
Rola różnorodności prób
Należy zdawać sobie sprawę, że w przypadku wielu badań genetycznych różnorodność pobieranych próbek jest głównym problemem (omówionym tutaj). W związku z tym staraliśmy się zwiększyć różnorodność w naszym zbiorze prób w miarę rozwoju badań (Rysunek 4). Podjęte wysiłki w zakresie pobierania próbek doprowadziły do zidentyfikowania nowych czynników genetycznych związanych z COVID-19 (nasze poprzednie wyniki są omówione w postach na blogach dla analiz nr 3 i 4). Dzięki jednoczesnej identyfikacji genetycznych czynników ryzyka za pomocą naszych metod analitycznych, jesteśmy w stanie obserwować warianty genetyczne w genach lub w ich pobliżu. Jak dotąd większość zidentyfikowanych przez nas genów wskazuje na zwiększone ryzyko związane z mechanizmami komórkowymi, regulacją odpowiedzi immunologicznej i czynnością serca. Identyfikacja tych czynników ryzyka może ostatecznie doprowadzić do rozwoju terapii ukierunkowanych na procesy związane ze zidentyfikowanymi genami.
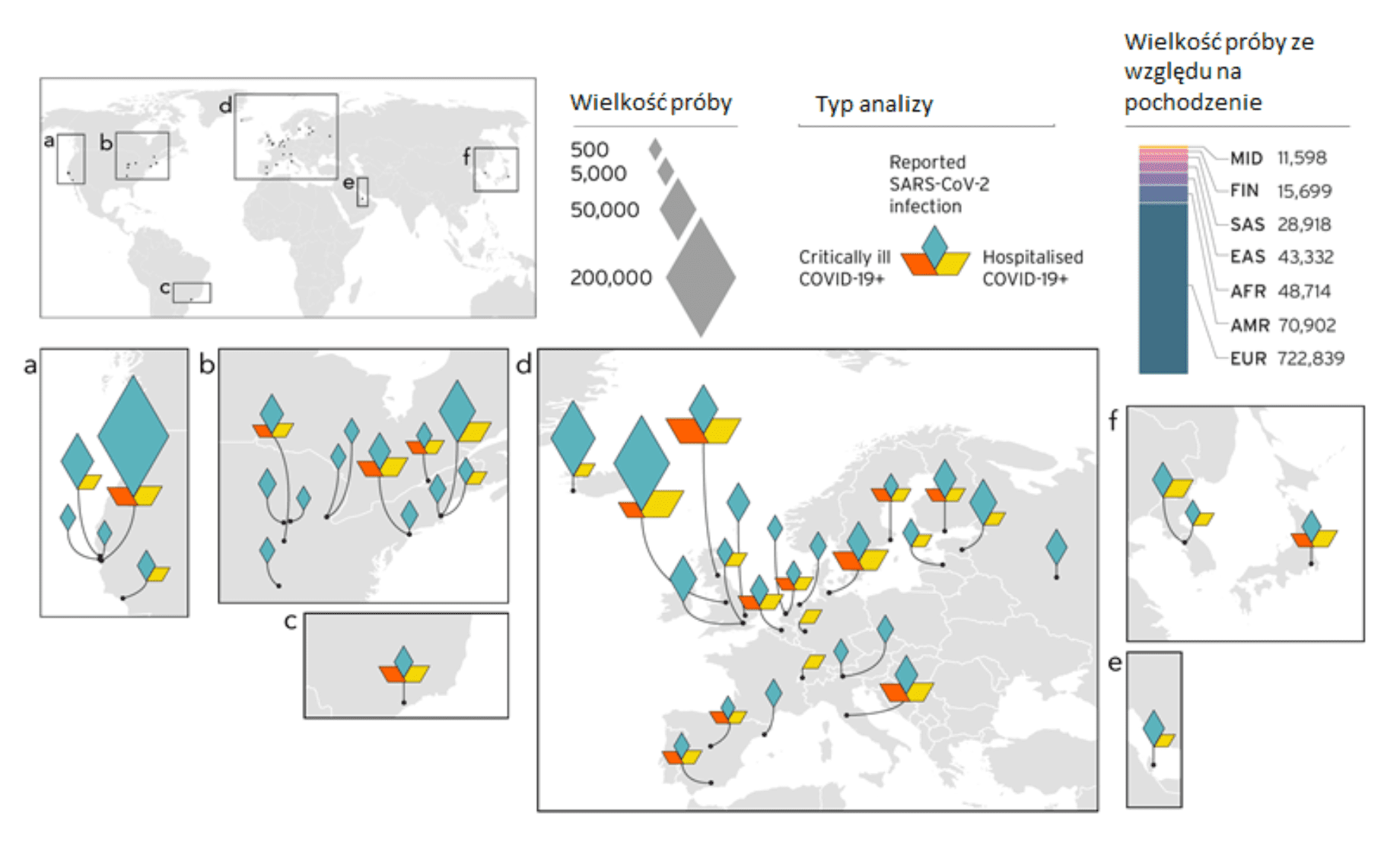
Rysunek 4. Przegląd badań konsorcjantów biorących udział w inicjatywie dotyczącej roli genetyki człowieka w przebiegu COVID-19 i rozkładu głównych grup etnicznych w meta-analizach. W analizie nr 5, 19 badań dotyczyło populacji pozaeuropejskich: 7 Afroamerykanów, 5 Amerykanów z domieszkami, 4 wschodnioazjatyckie, 2 południowoazjatyckie i 1 arabska. Diamenty reprezentują efektywną wielkość prób (wielkość prób, która będzie miała statystycznie istotny wpływ na uzyskane wyniki) badanych w różnych lokalizacjach geograficznych.
Zidentyfikowaliśmy 9 regionów chromosomowych związanych z chorobą COVID-19.
W analizie A, dotyczącej grupy osób z ciężkim przebiegiem choroby, zidentyfikowano związane z COVID-19 regiony chromosomowe zlokalizowane w pobliżu dwóch genów: LZTFL1 na chromosomie 3 oraz TAC4 na chromosomie 17. Białko LZTFL1 jest odpowiedzialne za transport białek przez błonę rzęskową. Rzęski to struktury podobne kształtem do włosów, wystające z komórek nabłonka. Rzęski wyściełają m.in. drogi oddechowe i płuca. LZTFL1 jest również zaangażowane w reakcje odpowiedzi immunologicznej. Z kolei białko TAC4 reguluje ciśnienie krwi oraz system immunologiczny.
W analizie B, dotyczącej grupy osób hospitalizowanych z powodu COVID-19, zidentyfikowaliśmy warianty związane z COVID-19 w regionach chromosomowych w okolicy 4 genów: Pierwszy to gen THBS3 zlokalizowany na chromosomie 1 kodujący białko THBS3. THBS3 ulega ekspresji w sercu, a jego produkcja jest zwiększona w chorobach serca. Drugi region to gen SCN1A na chromosomie 2. Warianty w tym genie mogą wywoływać epilepsję i drgawki. Trzeci region dotyczy genu TMEM65 na chromosomie 8. Gen ten koduje białko TMEM65 odgrywające rolę w rozwoju serca, regulacji przewodzenia impulsów w sercu oraz funkcjonowaniu serca. Może również brać udział w metabolizmie energii w komórce. Istotne jest to, że wariant zidentyfikowany w naszej analizę w genie TMEM65 występuje z częstością 12% w Azji Wschodniej, a tylko 1% populacji Europejskiej. Częstości alleli wskazują na ilość wariantów w danym genie lub rejonie genomowym. Ostatnim regionem zidentyfikowanym w tej analizie jest gen KANSL1 na chromosomie 17. Prawdopodobnie białko kodowane przez ten gen, KANSL1, odgrywa rolę z procesach neuronalnych.
Wreszcie, w analizie C, dla zgłoszonych infekcji SARS-CoV-2, znaleziono 3 nowe powiązania w regionach bliskich genom, ZBTB11 na chromosomie 3, DNAH5 na chromosomie 5 i PPP1R15A na chromosomie 19. Początkowo, zidentyfikowaliśmy region w okolicy genu ZBTB11 na chromosomie 3. Gen ten koduje białko ZBTB11, które, jak wykazano, reguluje rozwój komórek odpornościowych. Następnie, zidentyfikowaliśmy region w genie DNAH5 na chromosomie 5. Wykazano, że zmiany genetyczne w DNAH5 powodują pierwotną dyskinezę rzęsek oraz wadliwy ruch rzęsek, prowadzący do nawracających infekcji klatki piersiowej, objawów ucha / nosa / gardła, zapalenia oskrzeli i niepłodności. Wreszcie, zidentyfikowaliśmy region blisko genu PPP1R15A na chromosomie 19. Ten gen koduje białko PPP1R15A, które, jak wykazano, pośredniczy w zatrzymaniu wzrostu i śmierci komórki w odpowiedzi na uszkodzenie DNA, negatywnych sygnałach wzrostu i nieprawidłowe struktury białka.
W naszych analizach geny wpływające na układ odpornościowy odgrywają ważną rolę w COVID-19. Częścią naszych odkryć są również geny zaangażowane w czynność płuc i serca oraz procesy neuronalne. Choroby serca były wcześniej zgłaszane jako czynnik podatności na COVID-19 a objawy neuronalne były zgłaszane jako część choroby COVID-19.
Korelacja nie oznacza związku przyczynowego
Czynniki ryzyka zidentyfikowane w badaniach asocjacyjnych mogą nie wskazywać na przyczynę podatności lub ciężkości COVID-19. W związku z tym zastosowaliśmy metodę zwaną randomizacją mendlowską (MR), która wykorzystuje informacje genomowe do wnioskowania o związkach przyczynowych. MR to metoda wykorzystująca warianty genetyczne, o których wiadomo, że wpływają na daną ekspozycję (np. BMI) w celu zbadania przyczynowego wpływu wystawienia na efekty choroby. Aby przyjrzeć się bliżej, opisaliśmy MR w niedawnym poście na blogu (skierowanym do odbiorców naukowych). W ramach trzech fenotypów COVID-19 zidentyfikowaliśmy statystycznie istotne związki przyczynowe między trzema wynikami COVID-19 a 6 cechami (z 38 wybranych cech które przebadaliśmy, Rysunek 4), Stwierdziliśmy, że przewidywany genetycznie wyższy wskaźnik masy ciała (BMI) był związany z wyższym ryzykiem zakażenia SARS-CoV-2 i hospitalizacji z powodu COVID-19. Wynik ten potwierdza wyniki badań obserwacyjnych, które potwierdziły zwiększone ryzyko ciężkich następstw COVID-19 związane z wyższym BMI. Ponadto genetycznie przewidywanie palenie tytoniu wiązało się ze zwiększonym ryzykiem hospitalizacji z powodu COVID-19.
Rysunek 5: Korelacje genetyczne i szacunki przyczynowe dotyczące randomizacji mendlowskiej między 43 cechami a ciężkością COVID-19 i zakażeniem zgłoszonym przez SARS-CoV-2. Cechy są wymienione na osi X, a fenotypy COVID-19 na osi Y. Kolor niebieski reprezentuje ujemną korelację genetyczną i ochronne szacunki przyczynowe randomizacji mendlowskiej (MR), a kolor czerwony oznacza dodatnią korelację genetyczną i zwiększone ryzyko MR. Większe kwadraty odpowiadają bardziej znaczącej korelacji. Szacunki przyczynowe, które przekraczają próg istotności statystycznej, są oznaczone gwiazdką.
Globalna wspólna próba zrozumienia genetyki COVID-19
W obecnym globalnym kryzysie pandemii COVID-19 wyniki te pokazują siłę globalnego wysiłku 47 różnych uczestników. W sumie zidentyfikowaliśmy 15 regionów genomowych powiązanych z podatnością i ciężkością COVID-19. Aby dokładniej zbadać przyczynowość tych regionów, wykorzystaliśmy wnioskowanie statystyczne (tj. Randomizację mendlowską), aby zidentyfikować 8 cech o statystycznie istotnej przyczynowości sygnałami zidentyfikowanymi przy pomocy analiz GWAS. Obecnie finalizujemy nasze wyniki w artykule naukowym. W miarę jak będziemy walczyć z globalną pandemią COVID-19, Konsorcjum COVID-19 HGI będzie iteracyjnie publikować wyniki analiz genetycznych. Współpracując, możemy wygenerować solidne wnioski wymagane do lepszego zrozumienia czynników biologicznych i klinicznej prezentacji COVID-19.
